Заманбап медицина чөйрөсүндө антибиотиктер эң маанилүү жетишкендиктердин бири болуп чыкты, микробдук инфекциялар менен байланышкан оорулардын жана өлүмдүн көрсөткүчтөрүн кескин төмөндөттү. Алардын бактериялык инфекциялардын клиникалык натыйжаларын өзгөртүү жөндөмү сансыз бейтаптардын өмүрүн узартты. Антибиотиктер хирургиялык операциялар, импланттарды орнотуу, трансплантация жана химиотерапия сыяктуу татаал медициналык процедураларда абдан маанилүү. Бирок, антибиотиктерге туруктуу патогендер пайда болушу тынчсызданууну күчөтүп, убакыттын өтүшү менен бул дары-дармектердин натыйжалуулугун төмөндөтүп жатат. Микробдук мутациялар пайда болгондо, антибиотиктерге туруктуулук учурлары бардык категориядагы антибиотиктерде катталган. Микробдук дары-дармектердин тандоо басымы туруктуу штаммдардын көбөйүшүнө өбөлгө түзүп, дүйнөлүк саламаттыкты сактоо үчүн олуттуу көйгөй жаратты.
Микробго каршы туруктуулуктун актуалдуу маселесине каршы күрөшүү үчүн, антибиотиктерди колдонууну азайтуу менен бирге, туруктуу патогендердин жайылышын чектөөчү натыйжалуу инфекцияны көзөмөлдөө саясатын ишке ашыруу зарыл. Андан тышкары, альтернативдүү дарылоо ыкмаларына болгон муктаждык бар. Гипербарикалык кычкылтек терапиясы (ГБОТ) бул контекстте келечектүү ыкма катары пайда болду, ал белгилүү бир убакыт аралыгында белгилүү бир басым деңгээлинде 100% кычкылтекти ингаляциялоону камтыйт. Инфекцияларды негизги же кошумча дарылоо катары көрсөтүлгөн ГБОТ антибиотикке туруктуу патогендер козгогон курч инфекцияларды дарылоодо жаңы үмүт бериши мүмкүн.
Бул терапия сезгенүү, көмүртек кычкылы менен уулануу, өнөкөт жарааттар, ишемиялык оорулар жана инфекциялар сыяктуу ар кандай ооруларды дарылоодо негизги же альтернативдүү дарылоо катары барган сайын көбүрөөк колдонулууда. HBOTтун инфекцияны дарылоодо клиникалык колдонулушу терең, бул бейтаптарга баа жеткис артыкчылыктарды берет.

Инфекцияда гипербарикалык кычкылтек терапиясынын клиникалык колдонулушу
Учурдагы далилдер HBOTту өз алдынча жана кошумча дарылоо катары колдонууну бекем колдойт, бул инфекция жуккан бейтаптарга олуттуу пайда алып келет. HBOT учурунда артериялык кандын кычкылтек басымы 2000 мм рт.ст. чейин көтөрүлүшү мүмкүн, ал эми натыйжада пайда болгон жогорку кычкылтек-ткань басымынын градиенти ткандардын кычкылтек деңгээлин 500 мм рт.ст. чейин көтөрүшү мүмкүн. Мындай таасирлер ишемиялык чөйрөдө байкалган сезгенүү реакцияларынын жана микроциркуляциянын бузулуштарынын айыгышына көмөктөшүүдө, ошондой эле компартмент синдромун башкарууда өзгөчө баалуу.
HBOT иммундук системага көз каранды болгон абалдарга да таасир этиши мүмкүн. Изилдөөлөр көрсөткөндөй, HBOT аутоиммундук синдромдорду жана антиген менен индукцияланган иммундук реакцияларды басат, иммундук реакцияларды модуляциялоо менен лимфоциттердин жана лейкоциттердин кан айланышын азайтуу аркылуу трансплантаттын толеранттуулугун сактоого жардам берет. Мындан тышкары, HBOTайыгууну колдойтөнөкөт теринин жабыркашында ангиогенезди стимулдаштыруу аркылуу, бул калыбына келүүнү жакшыртуу үчүн маанилүү процесс. Бул терапия ошондой эле жарааттын айыгышынын маанилүү этабы болгон коллаген матрицасынын пайда болушун стимулдайт.
Айрым инфекцияларга, айрыкча некроздук фасциит, остеомиелит, өнөкөт жумшак ткандардын инфекциялары жана инфекциялык эндокардит сыяктуу терең жана дарылоо кыйын инфекцияларга өзгөчө көңүл буруу керек. HBOTтун эң кеңири таралган клиникалык колдонулуштарынын бири - көбүнчө анаэробдук же туруктуу бактериялар козгогон кычкылтектин деңгээлинин төмөндүгү менен байланышкан тери-жумшак ткандардын инфекциялары жана остеомиелит.
1. Диабеттик бут инфекциялары
Диабеттик бутКант диабети менен ооругандардын арасында жаралар кеңири таралган татаалдашуу болуп саналат жана бул калктын 25% га чейин жабыркайт. Инфекциялар көп учурда ушул жараларда пайда болот (учурлардын 40%-80% түзөт) жана оорунун жана өлүмдүн көбөйүшүнө алып келет. Диабеттик бут инфекциялары (ДБИ), адатта, ар кандай анаэробдук бактериялык патогендер аныкталган полимикробдук инфекциялардан турат. Фибробласт функциясынын кемчиликтери, коллагендин пайда болуу көйгөйлөрү, клеткалык иммундук механизмдер жана фагоцит функциясы сыяктуу ар кандай факторлор диабет менен ооругандарда жаралардын айыгышына тоскоол болушу мүмкүн. Бир нече изилдөөлөр теринин кычкылтек менен камсыз болушунун бузулушу ДБИге байланыштуу ампутациялардын күчтүү коркунуч фактору катары аныкталган.
DFI дарылоонун учурдагы варианттарынын бири катары, HBOT диабеттик бут жараларынын айыгуу көрсөткүчтөрүн бир топ жогорулатып, андан кийин ампутацияга жана татаал хирургиялык кийлигишүүлөргө болгон муктаждыкты азайтаары кабарланган. Ал капкак операциялары жана тери трансплантациясы сыяктуу ресурстарды көп талап кылган процедуралардын зарылдыгын минималдаштырып гана тим болбостон, хирургиялык варианттарга салыштырмалуу төмөн чыгымдарды жана минималдуу терс таасирлерди сунуштайт. Чен жана башкалар тарабынан жүргүзүлгөн изилдөө HBOTтун 10дон ашык сеансы диабет менен ооруган бейтаптарда жаралардын айыгуу көрсөткүчтөрүн 78,3% га жакшырткандыгын көрсөттү.
2. Некроздук жумшак ткандардын инфекциялары
Некроздук жумшак ткандардын инфекциялары (НТЖИ) көбүнчө полимикробдук мүнөзгө ээ, адатта аэробдук жана анаэробдук бактериялык патогендердин айкалышынан келип чыгат жана көбүнчө газдын пайда болушу менен байланыштуу. НТЖИ салыштырмалуу сейрек кездешсе да, алардын тездик менен өрчүп кетишинен улам өлүмдүн жогорку көрсөткүчү бар. Өз убагында жана туура диагноз коюу жана дарылоо жагымдуу натыйжаларга жетүү үчүн маанилүү, жана НТЖИни башкаруунун кошумча ыкмасы катары НТЖИде НТЖИни колдонуу боюнча талаш-тартыштар бар. Келечектеги көзөмөлдөнгөн изилдөөлөр жок болгондуктан, НТЖИде НТЖИни колдонуу боюнча талаш-тартыштар дагы эле бар.далилдер анын NSTI менен ооругандардын жашоо деңгээлинин жакшырышы жана органдардын сакталышы менен байланыштуу болушу мүмкүн экенин көрсөтүп турат.Ретроспективдүү изилдөө HBOT алган NSTI бейтаптарынын арасында өлүм көрсөткүчтөрүнүн олуттуу төмөндөшүн көрсөттү.
1.3 Хирургиялык аймактын инфекциялары
SSI инфекциянын анатомиялык жайгашкан жерине жараша классификацияланышы мүмкүн жана аэробдук жана анаэробдук бактерияларды кошо алганда, ар кандай патогендерден келип чыгышы мүмкүн. Стерилизациялоо ыкмалары, профилактикалык антибиотиктерди колдонуу жана хирургиялык практикадагы жакшыртуулар сыяктуу инфекцияны көзөмөлдөө чараларындагы жетишкендиктерге карабастан, SSIлер туруктуу татаалдашуу бойдон калууда.
Бир маанилүү серепте нейробулчуң сколиозу боюнча хирургияда терең SSIлердин алдын алууда HBOTтун эффективдүүлүгү изилденген. Операцияга чейинки HBOT SSIлердин пайда болушун бир топ азайтып, жарааттардын айыгышына көмөктөшүшү мүмкүн. Бул инвазивдүү эмес терапия жараат ткандарындагы кычкылтектин деңгээли жогорулаган чөйрөнү түзөт, бул патогендерге каршы кычкылдандыруучу өлтүрүүчү таасир менен байланыштуу. Мындан тышкары, ал SSIлердин өнүгүшүнө салым кошкон кандын жана кычкылтектин деңгээлинин төмөндөшүн чечет. Башка инфекцияны көзөмөлдөө стратегияларынан тышкары, HBOT, айрыкча, жоон ичеги процедуралары сыяктуу таза булганган операциялар үчүн сунушталган.
1.4 Күйүктөр
Күйүктөр – бул өтө ысыктан, электр тогунан, химиялык заттардан же радиациядан улам келип чыккан жаракаттар жана жогорку ооруга жана өлүмгө алып келиши мүмкүн. HBOT жабыркаган ткандардагы кычкылтектин деңгээлин жогорулатуу менен күйүктөрдү дарылоодо пайдалуу. Жаныбарлардагы жана клиникалык изилдөөлөр ар кандай натыйжаларды көрсөтсө да,күйүктү дарылоодо HBOTтун натыйжалуулугу, 125 күйүк алган бейтапты камтыган изилдөөдө HBOT өлүмгө же жасалган операциялардын санына олуттуу таасир этпегени, бирок орточо айыгуу убактысын кыскартканы (43,8 күнгө салыштырмалуу 19,7 күн) көрсөтүлгөн. HBOTту күйүктү комплекстүү башкаруу менен интеграциялоо күйүк алган бейтаптарда сепсисти натыйжалуу көзөмөлдөп, айыгуу убактысын кыскартып, суюктукка болгон муктаждыкты азайтышы мүмкүн. Бирок, HBOTтун кеңири күйүктөрдү башкаруудагы ролун ырастоо үчүн андан ары кеңири келечектүү изилдөөлөр талап кылынат.
1.5 Остеомиелит
Остеомиелит – бул көбүнчө бактериялык патогендерден улам пайда болгон сөөктүн же жилик чучугунун инфекциясы. Остеомиелитти дарылоо сөөктөрдүн кан менен камсыз болушунун начардыгынан жана антибиотиктердин жилик чучугуна чектелүү киришинен улам кыйынга турушу мүмкүн. Өнөкөт остеомиелит туруктуу патогендер, жеңил сезгенүү жана некроздук сөөк тканынын пайда болушу менен мүнөздөлөт. Рефрактердик остеомиелит тиешелүү дарылоого карабастан уланып же кайталанып турган өнөкөт сөөк инфекцияларын билдирет.
HBOT инфекцияланган сөөк ткандарындагы кычкылтектин деңгээлин бир кыйла жакшыртаары далилденген. Көптөгөн клиникалык учурлар жана когорттук изилдөөлөр HBOT остеомиелит менен ооругандардын клиникалык натыйжаларын жакшыртаарын көрсөтүп турат. Ал зат алмашуу активдүүлүгүн жогорулатуу, бактериялык патогендерди басуу, антибиотиктердин таасирин күчөтүү, сезгенүүнү азайтуу жана айыгууну тездетүү сыяктуу ар кандай механизмдер аркылуу иштейт окшойт.процесстер. HBOTдон кийин, өнөкөт, рефрактердик остеомиелит менен ооругандардын 60% дан 85% га чейин инфекциянын басылышынын белгилери байкалат.
1.6 Грибоктук инфекциялар
Дүйнө жүзү боюнча үч миллиондон ашык адам өнөкөт же инвазивдүү грибоктук инфекциялардан жабыркайт, бул жылына 600 000ден ашык өлүмгө алып келет. Грибоктук инфекцияларды дарылоонун натыйжалары көп учурда иммундук абалдын өзгөрүшү, негизги оорулар жана патогендин вируленттүүлүк мүнөздөмөлөрү сыяктуу факторлордон улам начарлайт. Коопсуздугу жана инвазивдүү эмес мүнөзүнөн улам HBOT оор грибоктук инфекцияларда жагымдуу терапиялык вариантка айланууда. Изилдөөлөр HBOT Aspergillus жана Mycobacterium tuberculosis сыяктуу грибоктук патогендерге каршы натыйжалуу болушу мүмкүн экенин көрсөтүп турат.
HBOT Aspergillus биофильминин пайда болушун басаңдатуу менен грибокко каршы таасирлерди күчөтөт, супероксиддисмутаза (SOD) гендери жок штаммдарда натыйжалуулуктун жогорулаганы байкалат. Грибок инфекциялары учурундагы гипоксиялык шарттар грибокко каршы дарыларды жеткирүүдө кыйынчылыктарды жаратат, бул HBOTдон кычкылтек деңгээлинин жогорулашын потенциалдуу пайдалуу кийлигишүүгө айлантат, бирок андан ары изилдөө зарыл.
HBOTтун микробго каршы касиеттери
HBOT тарабынан түзүлгөн гипероксикалык чөйрө антибактериалдык касиеттерди стимулдаштыруучу физиологиялык жана биохимиялык өзгөрүүлөрдү баштайт, бул аны инфекцияны дарылоонун натыйжалуу кошумча терапиясына айлантат. HBOT түз бактерициддик активдүүлүк, иммундук жоопторду күчөтүү жана белгилүү бир микробго каршы агенттер менен синергетикалык таасирлер сыяктуу механизмдер аркылуу аэробдук бактерияларга жана негизинен анаэробдук бактерияларга каршы укмуштуудай таасирин көрсөтөт.
2.1 HBOTтун түз антибактериалдык таасири
HBOTтун түз антибактериалдык таасири көбүнчө клеткалык зат алмашуу учурунда пайда болгон супероксиддик аниондорду, суутек перекисин, гидроксил радикалдарын жана гидроксил иондорун камтыган реактивдүү кычкылтек түрлөрүнүн (ROS) пайда болушуна байланыштуу.
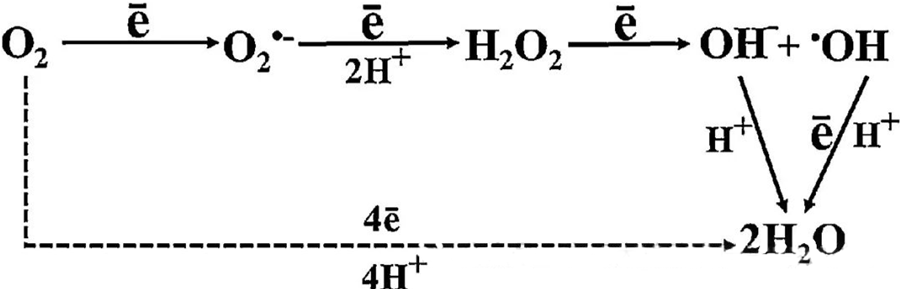
O₂ менен клеткалык компоненттердин өз ара аракеттенүүсү ROS клеткалардын ичинде кантип пайда болорун түшүнүүдө абдан маанилүү. Кычкылдануу стресси деп аталган белгилүү бир шарттарда ROS пайда болушу менен анын деградациясынын ортосундагы тең салмактуулук бузулат, бул клеткаларда ROS деңгээлинин жогорулашына алып келет. Супероксиддин (O₂⁻) өндүрүлүшү супероксиддисмутаза менен катализденет, ал кийинчерээк O₂⁻ суутек перекисине (H₂O₂) айлантат. Бул конверсия Фентон реакциясы менен ого бетер күчөйт, ал Fe²⁺ кычкылданып, гидроксил радикалдарын (·OH) жана Fe³⁺ пайда кылат, ошентип ROS пайда болушунун жана клеткалардын жабыркашынын зыяндуу кычкылдануу-калыбына келүү ырааттуулугун баштайт.
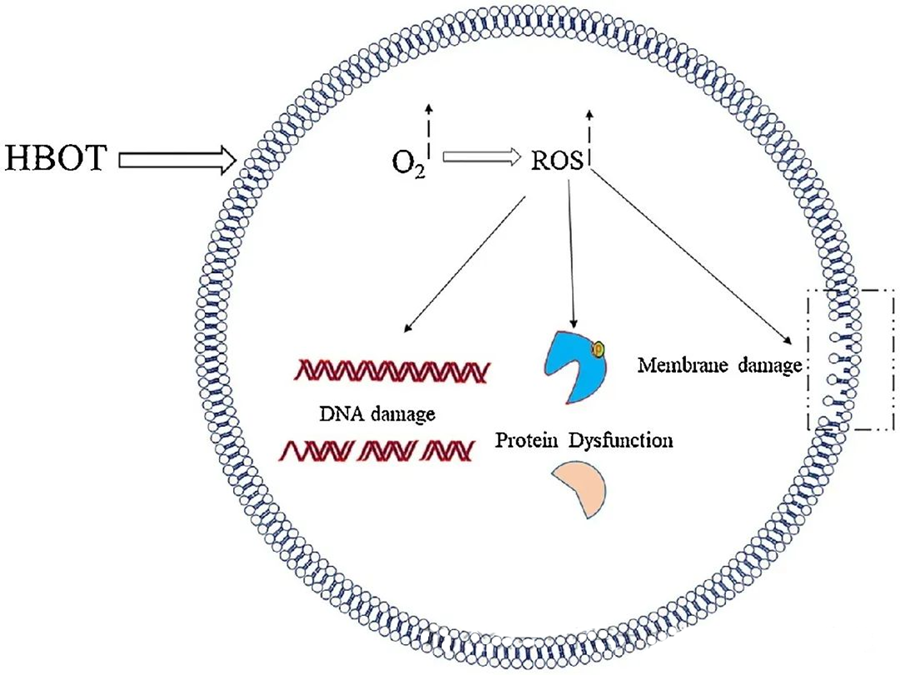
ROSтун уулуу таасири ДНК, РНК, белоктор жана липиддер сыяктуу маанилүү клеткалык компоненттерге багытталган. Белгилей кетчү нерсе, ДНК H₂O₂ аркылуу цитотоксикалык таасирдин негизги максаты болуп саналат, анткени ал дезоксирибоза түзүмдөрүн бузуп, базалык курамдарды бузат. ROS тарабынан келтирилген физикалык зыян ДНКнын спиралдык түзүлүшүнө чейин созулат, бул ROS тарабынан козголгон липиддердин пероксидациясынан келип чыгышы мүмкүн. Бул биологиялык системалардагы ROS деңгээлинин жогорулашынын терс кесепеттерин баса белгилейт.
ROSтун микробго каршы таасири
ROS микробдордун өсүшүн токтотууда маанилүү ролду ойнойт, бул HBOT тарабынан индукцияланган ROS пайда болушу аркылуу көрсөтүлөт. ROSтун уулуу таасири түздөн-түз ДНК, белоктор жана липиддер сыяктуу клеткалык курамдык бөлүктөргө багытталган. Активдүү кычкылтек түрлөрүнүн жогорку концентрациясы липиддерге түздөн-түз зыян келтирип, липиддердин пероксидациясына алып келиши мүмкүн. Бул процесс клетка мембраналарынын бүтүндүгүн жана натыйжада мембрана менен байланышкан рецепторлордун жана белоктордун функционалдуулугун бузат.
Мындан тышкары, ROSтун маанилүү молекулярдык буталары болгон белоктор цистеин, метионин, тирозин, фенилаланин жана триптофан сыяктуу ар кандай аминокислота калдыктарында белгилүү бир кычкылдануу модификацияларына дуушар болушат. Мисалы, HBOT E. coliдеги бир нече белоктордо, анын ичинде узаруу фактору G жана DnaKда кычкылдануу өзгөрүүлөрүн пайда кылып, ошону менен алардын клеткалык функцияларына таасир этери көрсөтүлгөн.
HBOT аркылуу иммунитетти күчөтүү
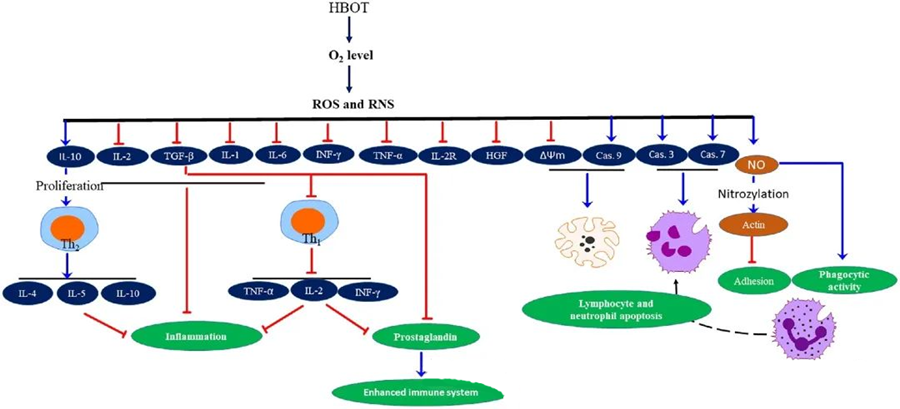
HBOTтун сезгенүүгө каршы касиеттериткандардын жабыркашын жеңилдетүү жана инфекциянын өнүгүшүн басуу үчүн абдан маанилүү экени далилденген документтештирилген. HBOT цитокиндердин жана башка сезгенүү жөнгө салуучуларынын экспрессиясына олуттуу таасир этет, иммундук жоопко таасир этет. Ар кандай эксперименталдык системалар HBOTдон кийин ген экспрессиясында жана белоктун пайда болушунда ар кандай өзгөрүүлөрдү байкашкан, алар өсүү факторлорун жана цитокиндерди жогорулатат же төмөндөтөт.
HBOT процесси учурунда O₂ деңгээлинин жогорулашы бир катар клеткалык реакцияларды пайда кылат, мисалы, сезгенүүнү пайда кылуучу медиаторлордун бөлүнүп чыгышын басуу жана лимфоциттер менен нейтрофилдердин апоптозун стимулдаштыруу. Жалпысынан бул аракеттер иммундук системанын микробго каршы механизмдерин күчөтүп, инфекциялардын айыгышына көмөктөшөт.
Андан тышкары, изилдөөлөр HBOT учурунда O₂ деңгээлинин жогорулашы сезгенүүнү пайда кылуучу цитокиндердин, анын ичинде интерферон-гамма (IFN-γ), интерлейкин-1 (IL-1) жана интерлейкин-6 (IL-6) экспрессиясын төмөндөтө аларын көрсөтүп турат. Бул өзгөрүүлөргө CD4:CD8 Т клеткаларынын катышын төмөндөтүү жана башка эрүүчү рецепторлорду модуляциялоо, акырында интерлейкин-10 (IL-10) деңгээлин жогорулатуу кирет, бул сезгенүүнү токтотуу жана айыгууну тездетүү үчүн абдан маанилүү.
HBOTтун микробго каршы активдүүлүгү татаал биологиялык механизмдер менен чырмалышкан. Супероксид жана жогорку басым HBOT тарабынан индукцияланган антибактериалдык активдүүлүктү жана нейтрофилдердин апоптозун ыраатсыз түрдө күчөтөөрү кабарланган. HBOTдон кийин кычкылтек деңгээлинин бир кыйла жогорулашы иммундук жооптун маанилүү компоненти болгон нейтрофилдердин бактерициддик жөндөмдүүлүктөрүн жогорулатат. Андан тышкары, HBOT нейтрофилдердин адгезиясын басат, ал нейтрофилдердеги β-интегриндердин эндотелий клеткаларындагы клетка аралык адгезия молекулалары (ICAM) менен өз ара аракеттенүүсү аркылуу ишке ашат. HBOT азот кычкылы (NO) аркылуу ишке ашырылган процесс аркылуу нейтрофилдердин β-2 интегрининин (Mac-1, CD11b/CD18) активдүүлүгүн басат, бул нейтрофилдердин инфекция жайгашкан жерге миграциясына өбөлгө түзөт.
Цитоскелеттин так кайра түзүлүшү нейтрофилдердин патогендерди натыйжалуу фагоциттештирүүсү үчүн зарыл. Актиндин S-нитрозилдеши актин полимерлешүүсүн стимулдай турганы, HBOT алдын ала дарылоодон кийин нейтрофилдердин фагоцитардык активдүүлүгүнө өбөлгө түзөрү көрсөтүлгөн. Андан тышкары, HBOT митохондриялык жолдор аркылуу адамдын Т-клетка линияларында апоптозду стимулдайт, HBOTдон кийин лимфоциттердин өлүмү тездейт. Каспаза-8ге таасир этпестен, каспаза-9ду бөгөттөө HBOTтун иммуномодулятордук таасирин көрсөттү.
HBOTтун микробго каршы агенттер менен синергетикалык таасири
Клиникалык колдонмолордо HBOT инфекциялар менен натыйжалуу күрөшүү үчүн антибиотиктер менен бирге көп колдонулат. HBOT учурунда жетишилген гипероксикалык абал айрым антибиотик агенттеринин натыйжалуулугуна таасир этиши мүмкүн. Изилдөөлөр көрсөткөндөй, β-лактамдар, фторхинолондор жана аминогликозиддер сыяктуу белгилүү бир бактерициддик дары-дармектер табигый механизмдер аркылуу гана иштебестен, бактериялардын аэробдук метаболизмине да жарым-жартылай көз каранды. Ошондуктан, антибиотиктердин терапиялык таасирин баалоодо кычкылтектин болушу жана патогендердин метаболикалык мүнөздөмөлөрү абдан маанилүү.
Кычкылтектин төмөн деңгээли Pseudomonas aeruginosa бактериясынын пиперациллинге/тазобактамга туруктуулугун жогорулата аларын жана кычкылтектин төмөн деңгээли Enterobacter cloacae бактериясынын азитромицинге туруктуулугунун жогорулашына өбөлгө түзөрүн олуттуу далилдер көрсөттү. Тескерисинче, айрым гипоксиялык шарттар бактериялардын тетрациклин антибиотиктерине сезгичтигин жогорулатышы мүмкүн. HBOT аэробдук метаболизмди индукциялоо жана гипоксиялык инфекцияланган ткандарды кайра кычкылтек менен камсыз кылуу, андан кийин патогендердин антибиотиктерге сезгичтигин жогорулатуу менен жашоого жөндөмдүү кошумча терапиялык ыкма катары кызмат кылат.
Клиникага чейинки изилдөөлөрдө, күнүнө эки жолу 280 кПа басымда 8 саат бою тобрамицин (20 мг/кг/күн) менен бирге колдонулган HBOT айкалышы Staphylococcus aureus инфекциялык эндокардитинде бактериялык жүктөмдү бир кыйла азайтты. Бул HBOTтун кошумча дарылоо катары потенциалын көрсөтүп турат. Андан аркы изилдөөлөр 37°C жана 3 ATA басымы астында 5 саат бою HBOT имипенемдин макрофагдар менен инфекцияланган Pseudomonas aeruginosaга каршы таасирин бир кыйла күчөткөнүн көрсөттү. Мындан тышкары, HBOTтун цефазолин менен айкалышкан ыкмасы жаныбарлардын моделдеринде Staphylococcus aureus остеомиелитин дарылоодо цефазолин менен гана дарылоого салыштырмалуу натыйжалуураак экени аныкталды.
HBOT ошондой эле ципрофлоксациндин Pseudomonas aeruginosa биофильмдерине каршы бактерициддик таасирин, айрыкча 90 мүнөттүк таасирден кийин, бир кыйла жогорулатат. Бул күчөш эндогендик реактивдүү кычкылтек түрлөрүнүн (ROS) пайда болушуна байланыштуу жана пероксидаза-дефекттүү мутанттарда жогорку сезгичтикти көрсөтөт.
Метициллинге туруктуу Staphylococcus aureus (MRSA) козгогон плеврит моделдеринде ванкомициндин, тейкопланиндин жана линезолиддин HBOT менен биргелешкен таасири MRSAга каршы натыйжалуулукту бир кыйла жогорулатты. Диабеттик бут инфекциялары (DFI) жана хирургиялык инфекциялар (SSI) сыяктуу оор анаэробдук жана полимикробдук инфекцияларды дарылоодо кеңири колдонулган антибиотик болгон метронидазол анаэробдук шарттарда жогорку микробго каршы натыйжалуулукту көрсөттү. HBOTтун метронидазол менен айкалыштырылган синергетикалык антибактериалдык таасирин in vivo жана in vitro шарттарында изилдөө үчүн келечектеги изилдөөлөр талап кылынат.
Резистенттүү бактерияларга каршы HBOTтун микробго каршы эффективдүүлүгү
Резистенттүү штаммдардын эволюциясы жана жайылышы менен салттуу антибиотиктер көп учурда убакыттын өтүшү менен өзүнүн күчүн жоготот. Андан тышкары, HBOT көп дарыга туруктуу патогендер козгогон инфекцияларды дарылоодо жана алдын алууда маанилүү болушу мүмкүн, бул антибиотикалык дарылоо натыйжасыз болгондо маанилүү стратегия болуп саналат. Көптөгөн изилдөөлөр HBOTтун клиникалык жактан маанилүү туруктуу бактерияларга олуттуу бактерициддик таасири жөнүндө кабарлашкан. Мисалы, саат 2де 90 мүнөттүк HBOT сеансы MRSAнын өсүшүн бир топ азайткан. Мындан тышкары, катыш моделдеринде HBOT ар кандай антибиотиктердин MRSA инфекцияларына каршы антибактериалдык таасирин күчөткөн. Отчеттор HBOT кошумча антибиотиктерди колдонбостон, OXA-48 өндүргөн Klebsiella pneumoniae козгогон остеомиелитти дарылоодо натыйжалуу экенин тастыктады.
Кыскасы, гипербарикалык кычкылтек терапиясы инфекцияны көзөмөлдөөнүн көп кырдуу ыкмасын билдирет, иммундук жоопту күчөтүү менен бирге, учурдагы микробго каршы агенттердин натыйжалуулугун жогорулатат. Ар тараптуу изилдөөлөр жана иштеп чыгуулар менен ал антибиотиктерге туруктуулуктун кесепеттерин азайтуу мүмкүнчүлүгүнө ээ, бул бактериялык инфекцияларга каршы уланып жаткан күрөштө үмүт берет.
Жарыяланган убактысы: 2025-жылдын 28-февралы

